缓冲溶液(缓冲溶液的ph值由哪些因素决定)
什么叫缓冲溶液其组成和作用如何
缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH值相对稳定。酸碱缓冲溶液在化学、生物化学和临床医学中,是维持生化反应向特定方向进行的重要因素。生物要维持生命活动,其pH必须保持在一定范围内,否则就会导致死亡。
缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的氢离子浓度指数值相对稳定。
缓冲溶液是一种能在加入少量酸或碱和水时大大降低pH变动幅度的溶液。缓冲体系由弱酸和它的盐。弱碱和它的盐。多元弱酸的酸式盐及其对应的次级盐的水溶液组成。pH缓冲系统对维持生物的正常pH值和正常生理环境起到重要作用。
什么叫缓冲溶液?它是如何配制的?
1、能够阻止pH值变化的溶液称为缓冲溶液。土壤质量 – ph值为8 – 1时利用氯化钡缓冲溶液对可交换阳离子和阳离子交换能力的测定为了能在吸取液体时操作方便,我们会利用已经含有适当缓冲溶液与两种限制酶的酵素反应混合液来操作。
2、缓冲溶液是无机化学及分析化学中的重要概念,缓冲溶液的pH值在一定的范围内不因稀释或外加少量的酸或碱而发生显著的变化,缓冲溶液依据共轭酸碱对及其物质的量不同而具有不同的pH值和缓冲容量。
3、缓冲溶液的配制主要是通过混合弱酸和其对应的弱酸盐,或者弱碱和其对应的弱碱盐的水溶液来实现。这些弱酸或弱碱在溶液中能够水解产生相应的氢离子或氢氧根离子,当外界加入强酸或强碱时,这些离子可以与外来的酸或碱发生反应,从而保持溶液的pH相对稳定。
4、缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH值相对稳定。酸碱缓冲溶液在化学、生物化学和临床医学中,是维持生化反应向特定方向进行的重要因素。生物要维持生命活动,其pH必须保持在一定范围内,否则就会导致死亡。
5、缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH值相对稳定。缓冲液的pH值与该酸的电离平衡常数Ka及盐和酸的浓度有关。弱酸的pKa值衡定,但酸和盐的比例不同时,就会得到不同的pH值。
缓冲溶液是如何维持pH稳定的?
1、缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH值相对稳定。在生化研究工作中,常常需要使用缓冲溶液来维持实验体系的酸碱度。研究工作的溶液体系pH值的变化往往直接影响到研究工作的成效。
2、在测定水的硬度时,缓冲溶液的使用非常关键。其主要功能是为了维持溶液的pH值在一个相对稳定的范围内,确保其变化幅度尽可能的小。这是因为水中钙镁离子与EDTA进行络合反应的过程中,会对pH值有一定的要求。当pH值发生变化时,可能会影响到络合反应的进行,从而影响到硬度测定的准确性。
3、缓冲液是一种化学溶液,用于控制溶液中的酸碱度保持稳定。缓冲液通常由弱酸或弱碱及其盐类组成。当向缓冲溶液中加入少量的酸或碱,或者在环境发生变化时,溶液的pH值会在这范围内波动较小,帮助保持相对的稳定状态。这是因为在缓冲液中,酸碱的加入会被缓冲物质所中和,从而减缓酸碱度的变化。
缓冲溶液的配制和性质
缓冲溶液的配制需要选择合适的酸碱对,并控制它们的浓度比例。一般来说,缓冲溶液由弱酸(或弱碱)和其共轭碱(或共轭酸)组成。根据所需的pH范围,可以选择合适的酸碱对,如乙酸与乙酸钠、磷酸与磷酸盐等。通过调整酸碱的浓度比例,可以控制缓冲溶液的pH值。
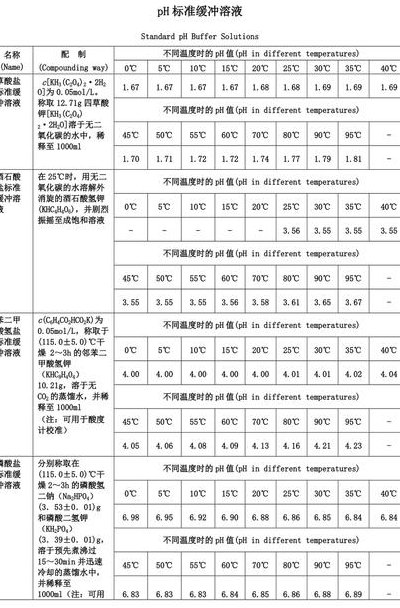
缓冲溶液的配制方法如下:购买酸标、中标、碱标。将三只250mL容量瓶用蒸馏水洗刷干净并晾干。注意塞子不能混用。将酸标袋用剪刀延边剪开。将粉末倒入用蒸馏水洗净的烧杯中。向烧杯中加入蒸馏水,并将酸标袋用蒸馏水冲洗两次,将溶液倒入烧杯中。用玻璃棒缓慢搅拌,使得固体物质溶解。
缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH值相对稳定。缓冲液的pH值与该酸的电离平衡常数Ka及盐和酸的浓度有关。弱酸的pKa值衡定,但酸和盐的比例不同时,就会得到不同的pH值。
缓冲溶液的配制如下:计算:需要称量的质量。称量或量取:固体试剂用分析天平或电子天平称量,液体试剂用量筒量取。溶解:将称好的固体放入烧杯,用适量蒸馏水溶解。转移:由于容量瓶的颈较细,为了避免洒在外面,用玻璃棒引流,玻璃棒不能紧贴容量瓶瓶口,棒底应靠在容量瓶瓶壁刻度线下。
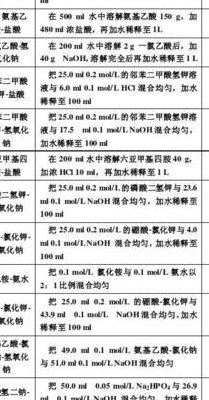
配制缓冲液:按照计算出的试剂量向去离子水中加入对应试剂,搅拌均匀直至完全溶解。 调整 pH 值:使用 pH 仪或 pH 试纸等工具检测缓冲液的 pH 值,如果偏离所需 pH 值,则可以添加稀盐酸或氢氧化钠等试剂调整 pH 值至所需值,最后搅拌均匀。
缓冲溶液的配制主要是通过混合弱酸和其对应的弱酸盐,或者弱碱和其对应的弱碱盐的水溶液来实现。这些弱酸或弱碱在溶液中能够水解产生相应的氢离子或氢氧根离子,当外界加入强酸或强碱时,这些离子可以与外来的酸或碱发生反应,从而保持溶液的pH相对稳定。
什么是缓冲溶液?它的作用是什么呢?
缓冲溶液是无机化学及分析化学中的重要概念,缓冲溶液的pH值在一定的范围内不因稀释或外加少量的酸或碱而发生显著的变化,缓冲溶液依据共轭酸碱对及其物质的量不同而具有不同的pH值和缓冲容量。
缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH值相对稳定。酸碱缓冲溶液在化学、生物化学和临床医学中,是维持生化反应向特定方向进行的重要因素。生物要维持生命活动,其pH必须保持在一定范围内,否则就会导致死亡。
缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的氢离子浓度指数值相对稳定。
缓冲溶液是一种能够抵抗外来少量强酸、强碱或稍加稀释等因素导致溶液酸碱度发生显著变化的化学溶液。它具有一个特定的pH范围,即使在这个范围内加入一定量的酸或碱,也能保持其pH相对稳定。这种特性使得缓冲溶液在化学、生物科学及许多工业领域中都有着广泛的应用。
,缓冲溶液是一种能在加入少量酸或碱和水时大大减低pH变动的溶液。pH缓冲系统对维持生物的正常pH值和正常生理环境起到重要作用。2,同离子效应:由于加入含相同离子的强电解质,使弱电解质电离度减小或使难溶盐溶解度降低的效应,叫同离子效应。