偏摩尔量(偏摩尔量的数值可以是正数负数和零)
偏摩尔量问题
只有广度性质才有对应的偏摩尔量。因为只有广度性质才与体系中物质的量有关。偏摩尔量也是状态函数,是强度性质。只有均相多组分体系才使用偏摩尔量的概念。单组分体系的偏摩尔量等于其摩尔量。
只有那些与体系中物质的量相关的性质,即广度性质,才有对应的偏摩尔量。偏摩尔量作为一种状态函数,其本质属于强度性质,它并不适用于单组分体系,因为单组分的偏摩尔量就等于其本身的摩尔量。
偏摩尔量加和公式如下:我们知道,不论是什么体系,物质的质量(克)和物质的量(摩尔)总是具有加和性的。但是,体系的其他广度性质则不一定具有简单的加和性。以体积这一广度性质为例,两组分混合前的体积之和(V1+V2)与混合后的实际体积(V)并不相等,即V1+V2≠V。
偏摩尔量随浓度变化,浓度不同时其值变不同。偏摩尔量是不同的物质组合在一起的,不同的物质含量,百分比不同,分子间的的作用力不同,体积的组合也不是直接相加,不同的含量,体积相加的时候结果也不同。如80ml的水和20ml的酒精体积加起来,与80ml酒精与20ml的水加起来的体积不同。
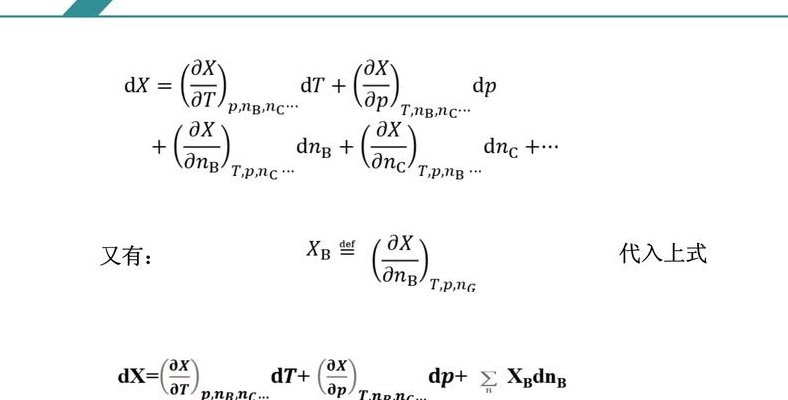
偏摩尔量的定义是,对于物质B的广度性质Z,它是B在等温等压下向无限大体系中加入1摩尔时,对Z的影响,或者在有限体系中加入微量B(dnB)时,对Z产生的微小变化的比值。
测色色差计中l值偏高是什么原因
1、“L”代表物体的明亮度:0-100表示从黑色到白色,l值越高,则越亮,还有问题可以咨询下彩谱科技。
2、刚接触色差仪的朋友,可能会对它显示的L,A,B数值感到困惑,其实它们代表物体颜色的色度值,即该颜色在色空间中的坐标。L值表示黑白深浅度,范围从0到100,值越大表示越白(亮),值越小表示越黑(暗)。A值表示红绿的差异,正值代表偏红,负值则代表偏绿。
3、Eab是总色差(判定是否合格);其中L:如果是正值,说明样品比标准板偏亮;如果是负值,说明偏暗;A:如果仪器显示是正值,说明样板比标准偏红,如果负值,说明偏绿;B:如果是正值,说明样板比标准偏黄,如果负值,说明偏蓝。
4、内部原因大体就是矫正问题和仪器本身质量或零件出现问题。
5、色差仪L、a、b、c、h的意思:L代表明暗度(黑白),a代表红绿色,b代表黄蓝色,c表示彩度(色彩饱和的程度或纯粹度),h表示色调角。
6、色差计又称为便携式色度仪、色彩分析仪、色彩色差计。 色差计是一种简单的颜色偏差测试仪器,即制作一块模拟与人眼感色灵敏度相当的分光特性的滤光片,用它对样板进行测光,关键是设计这种感光器的分光灵敏度特性,并能在某种光源下通过电脑软件测定并显示出色差值。
偏摩尔量和化学势的区别
描述对象不同:偏摩尔量描述的是化学反应中物质的数量与其浓度之间的关系;而化学势描述的是系统中物质的数量与其能量之间的关系。
化学势与偏摩尔量的关系是,化学势可以被视为一种特殊的偏摩尔量。 然而,偏摩尔量是一个更广泛的概念,它包括了各种不同的量,如系统的内能U、力F、焓H、自由能G和熵S等偏摩尔量。 实际上,任何体系的容量性质都可以相应地定义为偏摩尔量。
偏摩尔量就是解决“体系组成的变化对体系状态影响问题的”。
例2:氯化钠的偏摩尔吉布斯自由能,物理意义是往体系中加入微量氯化钠而引起该体系吉布斯自由能的变化量。
化学势和偏摩尔量的关系就像吉布斯自由能和能量、质量、体积等等广度量的关系一样,是一种和一类的关系。化学势是偏摩尔量的一种,就是偏摩尔吉布斯自由能。
在热力学中,偏摩尔量是指一种物质在系统中含量微小变化时,系统性质的变化量。它描述了物质性质对于物质数量的依赖性,是物质的一种基本属性。化学势作为一种偏摩尔量,具体而言,它表示在恒温恒压条件下,系统中单位物质的量的某一种物质所具有的吉布斯自由能增量。
偏摩尔量定义
1、偏摩尔量的定义:在温度、压力及除了组分B以外其余组分的物质的量均不变的条件下,广度量X随组分B的物质的量nB变化率XB称为组分B的偏摩尔量。物理意义:偏摩尔体积可以看作是某一定浓度溶液中1摩尔该组分体系总体积的贡献。
2、偏摩尔量,通常用partial molar quantity表示,它在特定的物理条件下得到了定义。这个条件是温度(T)、压力(P)保持恒定,且除了目标组分B外,其他所有组分的物质的量nC都保持不变。在这种情况下,广度量X随组分B的物质的量nB的变化率,即XB,被称为组分B的偏摩尔量。
3、偏摩尔量就是解决“体系组成的变化对体系状态影响问题的”。
偏摩尔量与摩尔量有什么异同
偏摩尔量,在温度、压力及除了组分以外其余组分的物质的量均不变的条件下,广度量随组分的物质的量的变化率称为组分的偏摩尔量。偏摩尔量就是解决“体系组成的变化对体系状态影响问题的”。摩尔量实际上是摩尔质量的简称。物质的量的单位是“摩尔”。每摩尔物质的质量叫“摩尔质量”。
partial molar quantity,在温度、压力及除了组分B以外其余组分的物质的量均不变的条件下,广度量X随组分B的物质的量nB变化率XB称为组分B的偏摩尔量。偏摩尔量就是解决“体系组成的变化对体系状态影响问题的”。
只有广度性质才有对应的偏摩尔量。因为只有广度性质才与体系中物质的量有关。偏摩尔量也是状态函数,是强度性质。只有均相多组分体系才使用偏摩尔量的概念。单组分体系的偏摩尔量等于其摩尔量。
定义不同:偏摩尔量是化学中用于描述化学反应中物质的数量与其浓度之间的关系的物理量。它被定义为在恒温恒压下,1mol纯物质完全反应时的物质变化量。而化学势则被定义为在恒温恒压下,系统中任一给定组分的摩尔数变化与系统总压力变化之间的比值。它被用来描述系统中物质的数量与其能量之间的关系。
对于均相多组分系统,只有在特定的温度(T)、压力(P)和物质的量(nC)条件下,系统广度性质Z对其他组分物质的量(nB)的偏导数才被称为偏摩尔量,这与一般的表达方式不同。在热力学关系式中,如内能U、焓H和吉布斯自由能G等广度性质,可以用它们的偏摩尔量替代,依然成立。
物理化学中偏摩尔量表达方式是什么?
偏摩尔量通常表示为 x,其计算公式为:x = n / N 其中,n 为某一种物质的分子数,N 为溶液中所有物质分子数之和。偏摩尔量的单位通常为无量纲。
偏摩尔量的数学表达式可以通过以下公式给出:XB = (φX/φnB) * T * P * nC,其中φX表示X的偏摩尔性质,φnB表示组分B的偏摩尔性质。对于纯物质,偏摩尔量的概念并不适用,此时它等同于常规的摩尔量。偏摩尔体积的概念则进一步扩展了偏摩尔量的内涵。
偏摩尔量的下脚标是T,P,nc(c不等于B)(即温度,压强,系统中其它组分的数量不变)。如果下脚标不是上述三个物理量,就不是偏摩尔量。不同容量性质表示的化学势的下脚标是不同的,只有用吉布斯自由能表示的化学势才是偏摩尔量,其它化学势的表示形式都不是偏摩尔量。
从定义式可以看出,偏摩尔量的物理意义是:在等温等压下,往无限大的体系中加入1摩尔B物质而引起体系广度性质Z的改变量;或者是,在有限的体系中加入微量B物质dnB而引起Z的微小变化dZ之比。
偏摩尔量的定义:在温度、压力及除了组分B以外其余组分的物质的量均不变的条件下,广度量X随组分B的物质的量nB变化率XB称为组分B的偏摩尔量。方程式:XB=(φX/φnB)T、P、nC对于纯物质,并不存在偏摩尔量的概念,它就是摩尔量。
偏摩尔量 partial molar quantity 体系中任一物质B的偏摩尔量xB的定义式为式中ne为溶液中除B物质的量nB以外所有其它物...偏摩尔量是强度性质,是一个微商的概念。可以理解为B物质处于溶液中时的摩尔量。