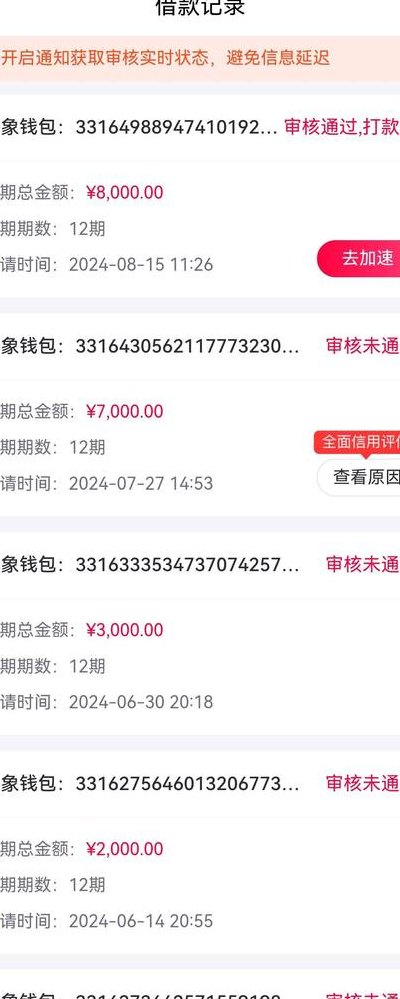
石蕊变色范围(甲基橙变色范围)
石蕊和酚酞的变色范围
石蕊指示液:变色范围 pH5~0(红→蓝)。酚酞指示液:变色范围 pH3~0(无色→红)。石蕊指示液:取石蕊粉末10g,加乙醇40ml,回流煮沸1小时,静置,倾去上层清液,再用同一方法处理2次,每次用乙醇30ml,残渣用水10ml洗涤,倾去洗液,再加水50ml煮沸,放冷,滤过,即得。
酚酞的变化范围:当溶液的酸碱度小于八,混合溶液为无色;当溶液的酸碱度处于八到十时,混合溶液为浅红色;当溶液的酸碱度大于十时,混合溶液为红色。
石蕊和酚酞都是酸碱指示剂,是一种弱的有机酸。石蕊是常用的酸碱指示剂,变色范围是pH0—0之间。石蕊起指示剂作用是由于石蕊中含石蕊精(C7H7O4N)的原因。酚酞是一种常用酸碱指示剂,广泛应用于酸碱滴定过程中。通常情况下酚酞遇酸溶液不变色,遇中性溶液也不变色,遇碱溶液变红色。
酚酞(Phenolphthalein)变色范围:pH 2 - 0 颜色变化:在pH 2以下为无色;中性(pH 2 - 0)时呈粉红色;pH 0以上变为鲜红色。
石蕊的颜色怎么变化
1、在酸性溶液中,主要以分子的形式存在,使溶液呈现红色;在碱性溶液中,石蕊水解的电离平衡向右移动,酸根离子成为存在的主要形式,因此溶液呈现蓝色;在中性溶液中,分子和酸根离子同时存在,导致溶液呈现紫色。石蕊和酚酞都是酸碱指示剂,它们都是弱有机酸。
2、颜色变化原理:在酸性溶液中,石蕊主要以分子的形式存在,这使得溶液呈现红色。这是因为在酸性条件下,石蕊分子中的平衡反应向左移动,增加了[H+]的浓度。 碱性溶液反应:在碱性溶液中,石蕊的水解反应导致平衡向右移动,酸根离子成为主要形式,因此溶液呈现蓝色。
3、石蕊(Litmus)是一种弱的有机酸,相对分子质量为3300,在酸碱溶液的不同作用下,发生共轭结构的改变而变色。
4、紫色石蕊遇酸变红,遇碱变蓝,遇呈碱性盐变蓝,遇中性盐不变色。无色酚酞遇酸不变,遇碱变红,遇呈碱性盐变红,遇中性盐不变色。ph值不同情况下颜色表现,石蕊红5紫8蓝,酚酞无8浅红10红。
5、石蕊是一种酸碱指示剂,其溶液在不同的pH值下会显示不同的颜色。在碱性环境中,石蕊溶液会变成蓝色;在酸性环境中,则会变成红色。石蕊溶液的变色范围是pH 0至0之间。
石蕊变色范围
石蕊指示液:变色范围 pH5~0(红→蓝)。酚酞指示液:变色范围 pH3~0(无色→红)。石蕊指示液:取石蕊粉末10g,加乙醇40ml,回流煮沸1小时,静置,倾去上层清液,再用同一方法处理2次,每次用乙醇30ml,残渣用水10ml洗涤,倾去洗液,再加水50ml煮沸,放冷,滤过,即得。
石蕊的变化范围:当溶液的酸碱度小于五时,混合溶液为红色;当溶液的酸碱度处于五到八时,混合溶液为紫色;当溶液的酸碱度大于八时,混合溶液为蓝色。
石蕊溶液:变色范围为0至0。pH小于0时呈红色,pH在0至0之间呈紫色,pH大于0时呈蓝色。在酸碱滴定中,选择指示剂时应考虑反应的终点pH值与指示剂变色范围的关系。例如,强酸滴定强碱时常用甲基橙作为指示剂,而强碱滴定强酸时则宜使用酚酞。
石蕊(Thymol blue)变色范围:pH 2 - 8 颜色变化:酸性(pH 2)时呈红色;中性(pH 2 - 8)时呈紫色;碱性(pH 8)时呈蓝色。
石蕊变色的ph值范围
1、石蕊的变色范围定位于pH值5至3之间。 石蕊,一种从地衣中提取的蓝紫色有机酸粉末,部分可溶于水,溶液呈紫色。 作为酸碱指示剂,石蕊依据溶液的酸碱性质发生结构变化,从而变色。 通常情况下,石蕊在pH值5至3的范围内变色,这一特性使其成为确定溶液酸碱性的有用工具。
2、石蕊是一种常见的酸碱指示剂,其变色范围在pH值0到0之间。 如果试液变红,表明溶液呈现酸性。 如果试液变蓝,表明溶液呈现碱性。 如果试液保持紫色,说明溶液是中性的。
3、石蕊的变色范围在pH值0至0之间。 作为酸碱指示剂,石蕊广泛应用于实验和工业领域。 石蕊蓝是从地衣植物中提取的一种天然蓝色色素。 该色素在水中部分溶解,呈现紫色。
4、石蕊是从地衣植物中提取的蓝色色素,部分溶于水呈紫色,常作为酸碱指示剂,变色范围在pH 5至3之间。 石蕊试纸是用于检测溶液酸碱性的古老方法之一,分为红色和蓝色两种试纸。 碱性溶液使红色石蕊试纸变蓝,酸性溶液使蓝色石蕊试纸变红。
高中化学常见指示剂变色范围
1、高中化学中,常用的指示剂包括甲基红、甲基橙、石蕊和酚酞。 甲基橙的变色范围介于1至4之间。小于1时呈现红色,介于1至4之间时呈现橙色,大于4时呈现黄色。 甲基红的变色范围为4至2。小于4时呈现红色,介于4至2之间时呈现橙色,大于2时呈现黄色。
2、变色范围:pH 0 - 6 颜色变化:在pH 0以下为红色;中性(pH 0 - 6)时呈黄色;pH 6以上变为蓝色。 铬酸钾(Potassium dichromate)变色范围:pH 0 - 3 颜色变化:在pH 0以下为橙色;中性(pH 0 - 3)时呈黄色;pH 3以上变为绿色。
3、高中化学常用的酸碱指示剂有甲基橙、石蕊和酚酞等变色范围如下:甲基橙:变色范围1~4,在这个变色范围内显橙色。小于1时显红色(酸色),大于1时显黄色(碱色)。甲基红:变色范围4~2,在这个变色范围内显橙色。小于4时显红色(酸色),大于2时显黄色(碱色)。
4、高中化学常用的指示剂有甲基红、甲基橙、石蕊和酚酞。甲基橙的变色范围为3点1~4点4,小于3点1为红色,在3点1到4点4之间为橙色,大于4点4为黄色。甲基红变色范围为4点4~6点2。小于4点4为红色,位于4点4到6点2之间为橙色,大于6点2为黄色。石蕊溶液变色范围为5到8。
5、高中化学常见的酸碱指示剂包括甲基橙、石蕊和酚酞,它们的变色范围如下: 甲基橙:变色范围是1至4,在此范围内显示橙色。当pH小于1时,呈现红色(酸性);pH大于1时,呈现黄色(碱性)。 甲基红:变色范围为4至2,在此范围内显示橙色。
6、在高中化学实验中,我们经常使用以下几种酸碱指示剂: 甲基橙:这种指示剂的变色范围介于1至4之间。当溶液的pH小于1时,甲基橙呈现红色;pH值在1至4之间时,它显示橙色;而pH大于4时,颜色变为黄色。 石蕊:石蕊溶液的变色范围在5至8之间。