石墨结构(石墨结构是什么)
石墨的组成,性质是什么
1、组成:石墨是碳的同素异形体之一,由碳原子通过共价键构成六边形的蜂巢状结构。 性质:- 耐高温性:石墨具有极高的熔点(约3850℃)和很小的热膨胀系数。在2000℃的高温下,其强度可增加一倍。- 导电、导热性:石墨的导电性远超一般非金属,导热性胜过多数金属,包括钢、铁和铅。
2、石墨的组成性质:石墨是元素碳的一种同素异形体,每个碳原子的周边连结著另外三个碳原子,排列方式呈蜂巢式的多个六边形,以共价键结合,构成共价分子。导电、导热性:石墨的导电性比一般非金属矿高一百倍。导热性超过钢、铁、铅等金属材料。导热系数随温度升高而降低,甚至在极高的温度下,石墨成绝热体。
3、石墨是元素碳的一种同素异形体,每个碳原子与另外三个碳原子通过共价键相连,形成蜂巢式六边形结构,这种独特的排列方式赋予了石墨一系列特殊性质。首先,石墨具有极高的耐高温性,熔点高达3850±50℃,沸点为4250℃,即使在超高温电弧灼烧下,其重量损失也很小,热膨胀系数也非常低。
石墨有哪些结构特点?这些结构特点与石墨的耐热性,导电导热性和自润滑...
耐热性 由于石墨层与层之间的弱相互作用,其在高温下相对稳定。虽然层与层之间的范德华力较弱,但每个碳原子与其相邻三个碳原子形成的共价键非常坚固,这使得石墨具有很高的熔点和优异的耐热性。 导电导热性 石墨中的层状结构使得电子能够在层内自由移动,类似于金属中的自由电子。
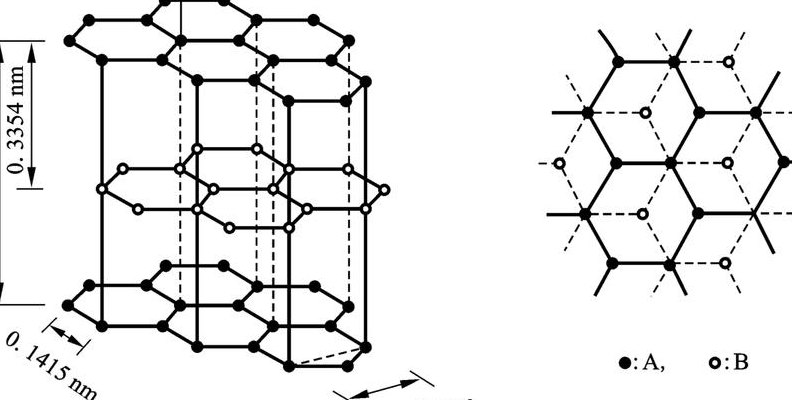
耐热性: 石墨晶体中层与层之间相隔340pm,距离较大,是以范德华力结合起来的,即层与层之间属于分子晶体。但是,由于同一平面层上的碳原子间结合很强,极难破坏,所以石墨的熔点很高,耐热。
石墨具有独特的晶体结构,其原子排列呈现出层状特征。这种结构赋予了石墨一些特殊的物理性质。首先,石墨具有极高的导电性,是优良的导电材料。其次,石墨的硬度适中,具有良好的耐磨性。此外,石墨还具有耐高温、耐化学腐蚀等特性,使其在多个领域有广泛的应用。石墨的应用领域非常广泛。
高纯石墨具备高强度、高密度、高纯度、化学稳定性高、结构致密均匀、耐高温、导电率高、耐磨性好、自润滑、易加工等特点。它在冶金、化工、航天、电子、机械、核能等多个工业领域有着广泛应用。尤其是在高科技和新技术领域,大规格高质量的高纯石墨更是有着宽广的应用空间。
石墨中为什么会含有大π键?
在石墨的每一层内,碳原子的p轨道上的电子形成了一个扩展的大π键。这些π电子可以在碳原子层的平面内自由移动,赋予石墨良好的导电和导热性能。 不同层之间的碳原子通过较弱的范德华力相互吸引,这些力使得层与层之间保持一定的距离,大约为340pm。
石墨晶体中的化学键主要与石墨晶体中碳原子的排列方式和成键方式有关。
石墨的结构是由碳原子通过SP2杂化形成的,这一过程与苯环的离域π键模型有相似之处。可以形象地将其看作多个苯环相互平行排列。 在石墨中,每个碳原子的一个s轨道和三个p轨道杂化,形成三个等价的sp2杂化轨道,这三个轨道相互之间形成σ键,其键角约为120°,且都在同一平面上。
nn。石墨的分子式是Cn,石墨中大π键是n中心n电子,这是因为在石墨(Cn)中的碳碳键的键角为120°,碳原子采用的是sp2杂化,有一个未参与杂化的电子成为了自由电子,自由电子可以在层内自由移动形成πnn大派键。因此石墨大π键是πnn。
这种力是由于碳原子周围的π电子形成的云在整个平面内弥散,产生一种弱的吸引力,使得层与层之间紧密排列但并不牢固连接。 大π键:在整个石墨分子层中,每个碳原子贡献了一个π电子,这些π电子在整个平面内自由移动,形成一个类似金属的大π键,它增强了层内的碳原子之间的结合。
石墨结构是什么呢?
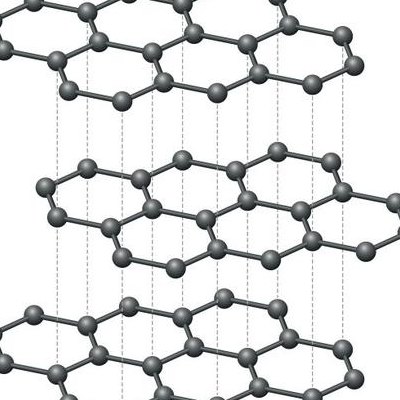
石墨的结构特征是由六边形的层状结构组成,这些层以sp2杂化方式形成共价键。 在石墨的每一层中,碳原子以正六边形的环状排列,每个碳原子与另外三个碳原子通过共价键相连。 这些碳原子在同一平面内排列,形成了类似蜂窝状的结构,层与层之间的相互作用较弱。
石墨的结构是由六边形层状组成的。它是介于原子晶体、金属晶体和分子晶体之间的一种特殊晶体类型。在石墨的晶体结构中,层内的碳原子通过sp杂化形成共价键,每个碳原子与另外三个碳原子相连,六个碳原子在同一平面上构成一个正六边形的环,这些层伸展开来形成片状结构。
石墨的结构是由碳原子通过共价键形成的六方晶格结构。每个碳原子与周围的三个碳原子相连,形成类似蜂巢的六边形排列。这种结构使得石墨具有良好的导电性和润滑性。石墨的用途广泛,包括制造铅笔芯、高温坩埚、电极、电刷和滑润剂等。
中国的石墨烯生产企业有哪些?
上海碳源汇谷新材料科技有限公司是一家石墨烯生产企业。 济南墨希新材料是另一家从事石墨烯生产的公司。 济宁利特纳米技术有限公司也从事石墨烯的生产。 天津普兰纳米科技有限公司是一家专注于石墨烯材料的企业。 北京吉安信科技有限公司涉足石墨烯领域。
中国的石墨烯生产企业包括贝特瑞、方大炭素、德尔未来、碳元科技、沃特股份、二维碳素等。贝特瑞作为石墨烯行业的龙头企业,不仅在石墨烯粉体和薄膜的生产方面拥有显著优势,还在新能源领域有着广泛的应用。其石墨烯业务营收在行业中处于领先地位,显示了其在石墨烯产业化方面的强劲实力。
碳元科技:国内高导热石墨散热材料领域的领先企业,专注于该材料的研发、生产和销售。 德尔未来:苏州的公司,与科研院所合作,推动石墨烯全产业链的技术进步,涉及锂离子负极材料和新能源储能产业。 德尔未来计划将石墨烯复合材料应用于家居产品,提升产品性能和环保性。
石墨为什么以sp2杂化轨道
1、石墨中的碳原子是sp2杂化而不是sp3杂化的主要原因是碳原子在石墨中形成了π键而不是σ键。在石墨中,每个碳原子与其他三个碳原子形成共价键,形成一个平面的六角环状结构。这种结构使得碳原子的杂化轨道发生变化。
2、石墨中的碳原子采用sp2杂化而非sp3杂化,这是由于石墨的结构特征决定的。 在石墨结构中,每个碳原子位于一个六边形的环中,与相邻的三个碳原子共享电子,形成三个σ键。这种排列方式使得碳原子的杂化轨道必须适应平面结构。
3、石墨的结构由多层的碳原子组成,每层中的碳原子以sp2杂化形成共价键。 在石墨中,每个碳原子与三个邻近的碳原子形成π键,这三个键构成了一个六边形的平面网络。
4、石墨中的碳原子采用sp2杂化,而非sp3杂化,主要因为石墨的结构特征导致了碳原子杂化方式的不同。 在石墨结构中,每个碳原子与其他三个碳原子形成了一个六边形的环状结构,这种结构迫使碳原子的杂化轨道重新排列。