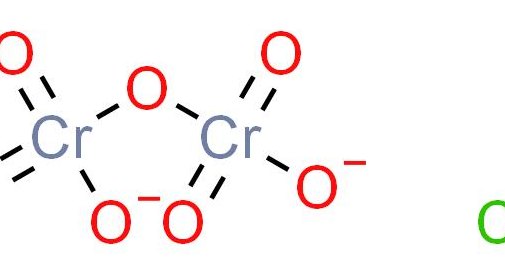
重铬酸根(重铬酸根和铬酸根的颜色)
铬酸根为什么会在酸性条件下转化成重铬酸根?
1、在酸性环境中,铬以重铬酸根的形式存在,这是由于其更倾向于接受氢离子,形成稳定的铬酸根离子。然而,当环境偏向碱性,铬酸根离子(CrO4)则占据主导,这是化学平衡在不同pH值下的自然选择。更进一步,铬的各种氧化态化合物展现出丰富多样的颜色特性。
2、在酸性条件下,铬酸根可以与氢离子(H)反应,生成重铬酸根和水。反应的化学方程式为:2CrO+2H→CrO+HO。在碱性条件下,重铬酸根可以与氢氧根离子(OH)反应,生成铬酸根和水。
3、铬酸根与重铬酸根的转化如下:在酸性条件下,铬酸根可以被强氧化剂如高锰酸钾(KMnO4)或过氧化氢(H2O2)氧化,从而转化为重铬酸根。反应的化学方程式为:6CrO42-+3H2SO4+3H2O2=2Cr2O72-+6H2O+3O2。
4、相互转化:向铬酸盐溶液中加入酸时,溶液由黄色变为橙色,表明铬酸根转变为重铬酸根,反之,向重铬酸盐溶液中加入碱时,溶液又由橙色变为黄色。铬酸盐的物质性质 铬酸盐具氧化性,还原CrVI常得到蓝绿色的CrIII。水溶液中,铬酸根离子(黄色)与重铬酸。根离子(橙色)处于平衡中。
铬酸根和重铬酸根转化离子方程式
1、反应的化学方程式为:Cr2O7^2-+2OH^-→2CrO4^2-+H2O。
2、在酸性条件下,铬酸根可以与氢离子(H)反应,生成重铬酸根和水。反应的化学方程式为:2CrO+2H→CrO+HO。在碱性条件下,重铬酸根可以与氢氧根离子(OH)反应,生成铬酸根和水。
3、Cr2O7 2-是重铬酸根,CrO4 2-是铬酸根,两者之间可以相互转化:2CrO4 2- + 2H+ ═ Cr2O7 2- + H2O Cr2O7 2-是橙黄色的,CrO4 2-是黄色的。
4、深入探讨:酸性环境中的铬酸根神秘转变在化学世界中,铬酸根(CrO4)与重铬酸根(Cr2O7)之间的转化,如同一场化学反应速率与平衡的精彩演绎。
重铬酸根与氢氧根为什么不能共存
会生成水和重铬酸盐。重铬酸根是一种强酸根,可以电离出氢离子。而氢氧根是一种弱碱离子,可以中和氢离子。当重铬酸根与氢氧根共存时,重铬酸根会电离出氢离子,与氢氧根中和,生成水和重铬酸盐。因此,重铬酸根与氢氧根不能共存。
综上所述,由于钠离子、羟基合铝离子、重铬酸根离子和亚硝根离子之间会发生不同的化学反应,共存时会导致化学平衡的破坏和体系的不稳定。这可能引发反应的剧烈变化,甚至产生有害物质或沉淀,对体系的稳定性和化学反应的正常进行造成影响。所以,在化学实验或工业过程中,需要注意避免这些离子的混合反应。
在碱性条件下,重铬酸根可以与氢氧根离子(OH)反应,生成铬酸根和水。反应的化学方程式为:CrO+2OH→2CrO+HO。这两个反应都是可逆的,因此铬酸根和重铬酸根可以在一定的条件下相互转化。
CrO42-+2H+=Cr2O72-+H2O。铬酸根离子(CrO4^2-)和重铬酸根离子(Cr2O7^2-)之间存在一种平衡转化关系。在酸性条件下,铬酸根可以与氢离子(H+)反应,生成重铬酸根和水。而在碱性条件下,重铬酸根可以与氢氧根离子(OH^-)反应,生成铬酸根和水。
重铬酸根离子是在酸性条件下稳定存在的,而碱性或中性中其会向铬酸根离子转化,碱性的强弱决定了这个转化率,当然该转化率还受到温度的影响。Cr2O4 2- +OH- →CrO4 2- 该反应可逆,加入氢氧根会向右移,加入氢离子会左移。重铬酸根是橙色,铬酸根是黄色,故加入氢氧根会由橙色变成黄色。
为什么重铬酸根水解得到铬酸跟:这是由于水解的原因所导致的:例如强碱弱酸盐的实质是弱酸根离子水解生成的产物是氢氧根离子和弱酸根离子。
重铬酸根和铬酸根怎么相互转化?
铬酸根与重铬酸根的转化如下:在酸性条件下,铬酸根可以被强氧化剂如高锰酸钾(KMnO4)或过氧化氢(H2O2)氧化,从而转化为重铬酸根。反应的化学方程式为:6CrO42-+3H2SO4+3H2O2=2Cr2O72-+6H2O+3O2。
这两个反应都是可逆的,因此铬酸根和重铬酸根可以在一定的条件下相互转化。这种转化在化学分析和工业应用中都具有重要意义。例如,在铬酸盐的制备过程中,可以通过调节溶液的酸碱性来控制产物中铬酸根和重铬酸根的比例。
CrO42-+2H+=Cr2O72-+H2O。铬酸根离子(CrO4^2-)和重铬酸根离子(Cr2O7^2-)之间存在一种平衡转化关系。在酸性条件下,铬酸根可以与氢离子(H+)反应,生成重铬酸根和水。而在碱性条件下,重铬酸根可以与氢氧根离子(OH^-)反应,生成铬酸根和水。
铬酸根与重铬酸根的转化
1、铬酸根与重铬酸根的转化如下:在酸性条件下,铬酸根可以被强氧化剂如高锰酸钾(KMnO4)或过氧化氢(H2O2)氧化,从而转化为重铬酸根。反应的化学方程式为:6CrO42-+3H2SO4+3H2O2=2Cr2O72-+6H2O+3O2。
2、在酸性条件下,铬酸根可以与氢离子(H)反应,生成重铬酸根和水。反应的化学方程式为:2CrO+2H→CrO+HO。在碱性条件下,重铬酸根可以与氢氧根离子(OH)反应,生成铬酸根和水。
3、CrO42-+2H+=Cr2O72-+H2O。铬酸根离子(CrO4^2-)和重铬酸根离子(Cr2O7^2-)之间存在一种平衡转化关系。在酸性条件下,铬酸根可以与氢离子(H+)反应,生成重铬酸根和水。而在碱性条件下,重铬酸根可以与氢氧根离子(OH^-)反应,生成铬酸根和水。
4、铬酸根与重铬酸根的转化如下:向铬酸盐溶液中加入酸时,溶液由黄色变为橙色,表明铬酸根转变为重铬酸根。反之,向重铬酸盐溶液中加入碱时,溶液又由橙色变为黄色。
亚铁和重铬酸的离子方程式是什么?
亚铁和重铬酸根的离子方程式为:6Fe + Cr2O7 + 14H=2Cr + 7HO + 6Fe亚铁离子一般呈浅绿色,有较强的还原性,能与许多氧化剂反应,如氯气,氧气等。
离子方程式:Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O【它只属于氧化还原反应配平这一块,不会叫你写方程,但会补全和配平方程。
(Fe2+)+(Cr2O7)(2-)+14(H+)=2(Cr3+)+7H2O+6Fe3+ 重铬酸根有强氧化性,能将亚铁离子氧化成三价铁离子,自身被还原为三价铬离子。
化学计量点:即重铬酸钾恰好与硫酸亚铁恰好反应完全.K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O 达到化学计量点时,理论上重铬酸根、亚铁离子的浓度为零。铁离子与铬离子的关系为:设铬的浓度为1,则铁离子浓度为3,注此是摩尔浓度的关系。
亚铁离子是铁的一种氧化态,而铁离子是较高的氧化态。当重铬酸根与亚铁离子反应时,重铬酸根上的氧原子被转移给亚铁离子,使其氧化为铁离子。亚铁离子的电子配置为[Ar]3d^6,而铁离子的电子配置为[Ar]3d^5。重铬酸根从亚铁离子中接受一个电子,使其氧化为铁离子。