休克尔规则(休克尔规则的兀电子数如何算)
如何判断分子是否具有芳香性?
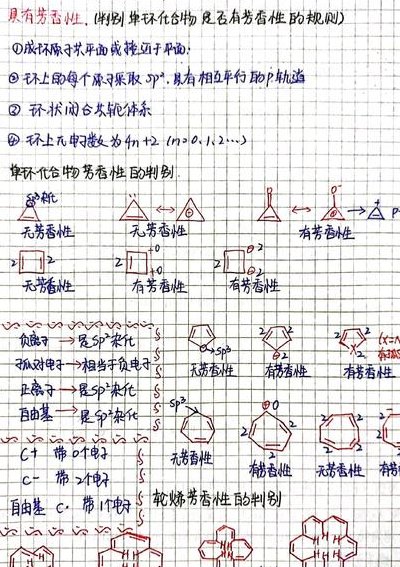
休克尔规则(Hückels rule)是有机化学中用于判断分子是否具有芳香性的经验规则。根据该规则,当闭合环状平面型的共轭多烯(轮烯)π电子数为4n+2时,分子具有芳香性。首先,休克尔规则有三个核心要素:闭合环状平面型、共轭多烯或平面连续共轭结构以及π电子数为4n+2。这三个要素缺一不可。
π电子指π键上的电子,一个双键有两个π电子,一个三键有四个π电子。
判断芳香性的关键在于分子结构的平面性以及π电子的分布。首先,所有原子必须共平面,这是基本条件之一。其次,根据著名的4n+2个π电子规则,如果一个分子有偶数个π电子(每个双键贡献2个π电子),则它可能具有芳香性。
休克尔规则的原理是什么?
1、休克尔规则是有机化学的经验规则,它指当闭合环状平面型的共轭多烯(轮烯)π电子数为(4n+2)时(其中n为0或者正整数),具有芳香性。
2、休克尔规则是一种用于预测元素电子排布的经验规则,它可以帮助我们快速地确定一个原子中电子的排布方式。在休克尔规则中,n代表的是主量子数,可以通过元素的周期数来确定。具体来说,n的取值范围为1到周期数,周期数即为元素在元素周期表中所处的横行数。
3、休克尔规则揭示了具有特定π电子数的分子可能展现出特殊芳香稳定性。这一规则指出,对于完整的共轭、单环、平面多烯分子,当π电子数为(4n+2)形式(n为大于或等于零的整数)时,分子可能具有这种稳定性。随着磁共振实验方法的引入,我们对化合物芳香性的判断和理解有了显著提升。
4、休克尔规则是通过分子轨道理论的简化形式呈现的,骨架原子的p轨道协同形成共轭π键,构建出哈密顿量矩阵。这些矩阵的特征值决定了轨道的能量分布,而中性分子的电子总数则决定了它是否满足芳香性条件,正负离子则需相应调整这个规则。
5、休克尔规则如何在分子轨道理论中体现呢?考虑具有[公式] 个骨架原子的共轭 π 体系。如果它是中性分子,电子数即为 [公式] ;如果它是正离子,电子数即为 [公式] ;如果它是负离子,电子数即为 [公式] 。对中性分子,骨架和电子数都为[公式] ,且为偶数(电子要成对),故 [公式] 。
6、休克尔规则数电子的方法是:首先一个双键两个pi电子,对于杂环化合物,要注意杂原子是否有孤对电子,如吡咯的氮上有两个单电子也进入了共轭体系,故其虽然只有两个双键却有六个pi电子。另外还要注意是环上带电荷。
如何判断一个物质是否有芳香性
芳香性的判断依据:一个物质是否具有芳香性,取决于其是否形成了一个闭合的共轭π电子体系。这种体系具有高度的电子离域性,使得π电子能够在环状结构中自由运动,从而降低了体系的能量,使其变得更加稳定。
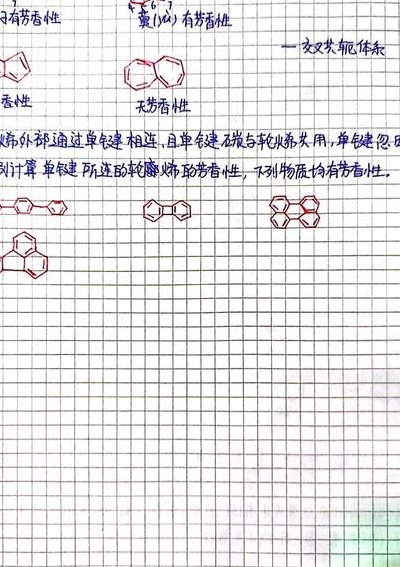
一个物质是否有芳香性的判断依据是休克尔规则,凡符合休克尔规则,则该物质具有芳香性。休克尔规则:一个单环化合物只要具有平面离域体系,它的π电子数为4n加2,则具有芳香性,其中n相当于简并的成键轨道和非键轨道的组数。
判断具有芳香性要符合休克尔规则:一个单环化合物只要具有平面离域体系,它的π 电子数为4n+2(n=1,2,3,…整数),就有芳香性(当 nu003e7 时,有例外)。或者说单环、平面、闭合兀体系、具有4n+2个丌电子的化合物具有芳香性。
根据休克尔规则判断有机物是否有芳香性。休克尔规则的内容是一个单环化合物只要它的π电子数为 4n+2(n=0,1,2,3,…n属于整数),并且具有平面离域体系,就有芳香性。其中n指的是合并的成键轨道和非键轨道的组数。芳香性在化学性质上表现为易进行亲电取代反应,不易进行加成反应和氧化反应。
一个物质是否有芳香性是有三点。上面已经提到4n+2规则了。看下其他两点:1,分子要近平面。2,分子要环状。3,其中第一点,分子要平面说明成环的原子要在一个平面上。这个与杂化有关,比如环戊二烯,其中有一个碳没有在其他四个碳的平面上,而且不满足4n+2规则。
芳香性的单环化合物具备平面离域体系,其π电子数为4n+2,其中n为整数。当n大于7时,此规则有例外。 单环、平面、闭合π体系,且具有4n+2个π电子的化合物通常表现出芳香性。
什么是休克尔规则?
1、休克尔规则(Hückels rule)是一个经验规则,用以判断具有共轭烯烃结构的环状有机化合物是否具有芳香性。该规则指出,如果参与构成共轭 π 电子的个数为 4n+2 个,其中 n 为自然数(如 2, 6, 10, 14 等),则此化合物就具有芳香性;反之,则不具有芳香性。
2、休克尔规则是有机化学的经验规则,它指当闭合环状平面型的共轭多烯(轮烯)π电子数为(4n+2)时(其中n为0或者正整数),具有芳香性。
3、休克尔规则是一种用于预测元素电子排布的经验规则,它可以帮助我们快速地确定一个原子中电子的排布方式。在休克尔规则中,n代表的是主量子数,可以通过元素的周期数来确定。具体来说,n的取值范围为1到周期数,周期数即为元素在元素周期表中所处的横行数。
4、休克尔规则(Hückels rule)是判断具有共轭烯烃结构的环状有机化合物芳香性的经验规则,规则表明若参与共轭的π电子总数为4n+2(n为自然数),则化合物具有芳香性;反之则无。
休克尔规则怎么数电子
1、休克尔规则数电子的方法是:首先一个双键两个pi电子,对于杂环化合物,要注意杂原子是否有孤对电子,如吡咯的氮上有两个单电子也进入了共轭体系,故其虽然只有两个双键却有六个pi电子。另外还要注意是环上带电荷。
2、休克尔规则提供了数π电子数的关键条件与方法。首先,一个体系必须具备环状闭合的共平面共轭体系。其次,π电子数需要满足4n+2的规律,其中n为整数且n大于等于0。为了计算π电子数,我们可以采用以下步骤:在共轭体系中,每一个未饱和的碳原子算作一个电子。接着,对带电的离子体系进行分析。
3、休克尔规则π电子数怎么数介绍如下:环上π电子数为4n+2 (n= 0、3……)。休克尔规则和芳香性:芳香烃不一定都含有苯环。对非芳香烃预见分子芳香性的重要规则是休克尔规则。
休克尔规则
休克尔规则(Hückels rule)是一个经验规则,用以判断具有共轭烯烃结构的环状有机化合物是否具有芳香性。该规则指出,如果参与构成共轭 π 电子的个数为 4n+2 个,其中 n 为自然数(如 2, 6, 10, 14 等),则此化合物就具有芳香性;反之,则不具有芳香性。
休克尔规则(Hückels rule)是判断具有共轭烯烃结构的环状有机化合物芳香性的经验规则,规则表明若参与共轭的π电子总数为4n+2(n为自然数),则化合物具有芳香性;反之则无。
休克尔规则:一个单环化合物只要具有平面离域体系,它的π电子数为4n加2,则具有芳香性,其中n相当于简并的成键轨道和非键轨道的组数。