复分解反应的定义(初中化学复分解反应的定义)
复分解反应的定义与条件是什么
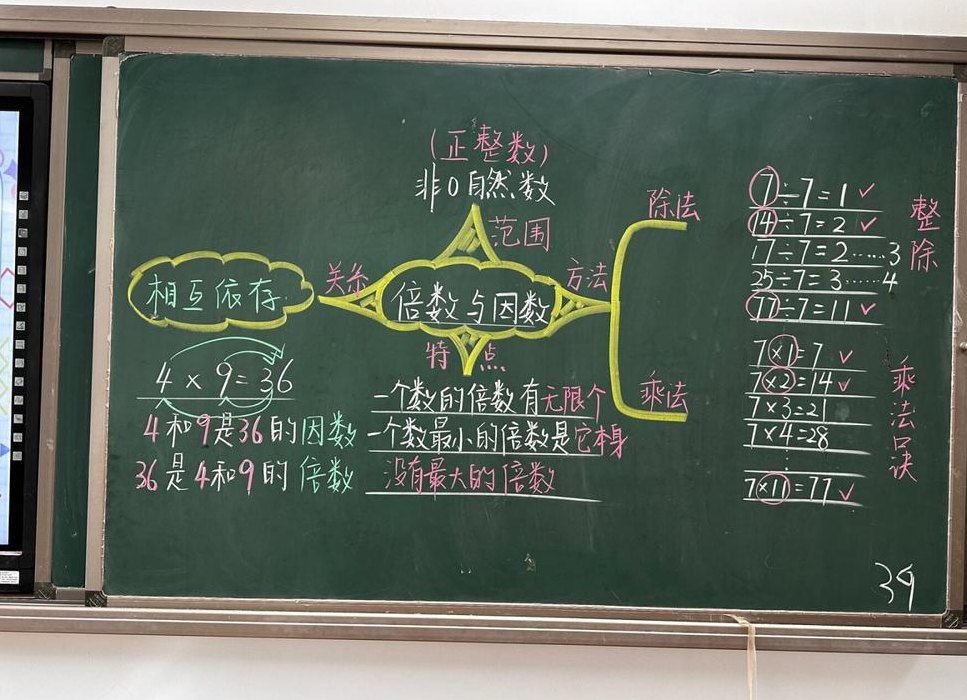
复分解反应的定义:复分解反应是两种化合物之间的组分交换,产生另外两种化合物的反应,它的本质是水溶液中两种具有复分解交换离子的化合物,结合形成难以电离的沉淀物、气体或弱电解液(最常见的是水),降低溶液中的离子浓度,化学离子浓度降低的反应。
复分解反应的定义:复分解反应是由两种化合物互相交换成分, 生成另外两种化合物的反应,其实质是发生复分解反应的两种化合物在水溶液中交换离子,结合成难电离的沉淀、气体或弱电解质(最常见的为水),使溶液中离子浓度降低,化学反应向着离子浓度降低的方向进行的反应 。
[小结] 复分解反应发生的条件:(1)、反应物:必须可溶(包括可溶入酸)(2)、生成物:有沉淀、气体或水生成。
恒电位仪测量极化曲线的原理是什么?
1、对于能够钝化的金属,其阳极极化曲线具有活化-钝化转变行为,因此其电流密度与电位不是一一对应的,一个电流值可能对应多个电压值,因此测量时不能以电流密度做为自变量,也就是说不能采用恒电流法,只能采用恒电位法。
2、测阳极极化,一般会伴随着 阳极钝化之类的过程(而且我觉得主要就是研究这种钝化的过程的,一般而言),通过恒定电位,得到不同的电流密度,从而得到极化曲线。如果用恒电流法的话,就没办法研究这种钝化的过程了。因为已经让电路的电流恒定了。而且,可能会出现一个电流下,有不同的几个电位的情况。
3、极化曲线的测定是研究电极过程机理及影响因素的重要方法之一。通过稳态恒电位法,可以掌握金属极化曲线的基本原理和测试方法,深入了解极化曲线的意义和应用。恒电位法是将研究电极依次恒定在不同的电位上,测量对应电流。在实验中,稳态体系的极化电流、电极电势及表面状态基本不随时间变化。
4、恒电流法是通过恒电流仪等仪器控制不同的电流密度,测定相应的电极电位值。将测得的一系列电流密度和电极电位对应值绘成曲线或通过记录仪自动记录画出曲线,即为恒流极化曲线。该法所用仪器简单,容易实现,所以应用较早,但控制电流法只适用于测量单值函数的极化曲线。
复分解反应的概念??
复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应 ,其实质是发生复分解反应的两种化合物在反应体系中(大部分情况为水溶液)交换离子,结合成难电离的沉淀、气体或弱电解质(最常见的为水),使反应体系中离子浓度降低,化学反应向着离子浓度降低的方向进行的反应 。
概念:复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应。复分解反应的实质是发生复分解反应的两种物质在水溶液中交换离子,结合成难解离的物质沉淀 、气体或弱电解质,最常见的为水,使溶液中离子浓度降低,化学反应即向着离子浓度降低的方向进行。
复分解反应是指两种化合物在水溶液中互相交换成分,生成另外两种化合物的反应。 复分解反应属于四大基本反应类型之一,其核心是离子的交换,形成难以电离的物质,如沉淀、气体或弱电解质,以此来降低溶液中的离子浓度,推动化学平衡反应的进行。