氯气的实验室制法(氯气的实验室制法反应原理离子方程式)
氯气是如何制得的?
盐电解法:盐电解法是目前最常用的制取氯气的方法。它通过将食盐(氯化钠)溶解在水中形成盐水溶液,然后通过电解将盐水分解成氯气和氢气。在电解槽中,盐水被注入,并且在阳极和阴极之间加上直流电压。
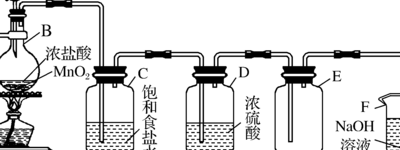
解析:用浓盐酸跟二氧化锰混合加热制取氯气。
通过高锰酸钾和浓盐酸在加热的条件下可以制取氯气。该反应为氧化还原反应,高锰酸钾作为氧化剂,把盐酸中的-1价氯离子氧化为0价的氯气。在反应中高锰酸钾中+7价的锰元素被还原为+2价的锰元素。
实验室里也可用其他氧化剂来氧化浓盐酸制取氯气。反应原理:最常用MnO2 + 4HCl(浓) ==加热== MnCl2+ 2H2O + Cl2 ↑ 常用的氧化剂还有有KMnOKClOCa(ClO)2等。
实验室制备氯气的方法和装置因不同的实验条件而有所不同。以下是几种常见的方法:固相法:在高温下,将含氯元素的无机盐(如氯化钠、氯化钙等)与固体催化剂(如氧化铝、五氧化二钒等)混合研磨,即可得到氯气。
制备氯气的离子方程式为:MnO2 + 2Cl- + 4H+= Cl2 +Mn2+ + 2H2O。其中,二氧化锰的猛元素的化合价由+4变为+2,化合价降低,作了氧化剂;而氯元素的化合价从-1升高到了0,作了还原剂。
氯气的实验室制法化学方程式
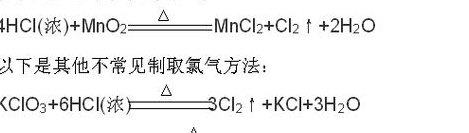
1、氯气的实验室制法:MnO2+4HCl(浓)═△═MnCl2+Cl2↑+2H2O 氯气,化学式为Cl。
2、氯气的实验室制法方程式是MnO2+4HCl==△==MnCl2+Cl2↑+2H2O。氯气(chlorine)是氯元素形成的一种单质,化学式Cl2。常温常压下为黄绿色,有强烈刺激性气味的剧毒气体,具有窒息性,密度比空气大。
3、方程式为:4HCl(浓)+MnO =加热=MnCl+Cl↑+2HO或者16HCl+2KMnO=2KCl+2MnCl+8HO+5Cl↑实验室通常用氧化浓盐酸的方法来制取氯气。
4、实验室制取氯气一般有3种方法:MnO2+4HCl=△=MnCl2+Cl2↑+2H2O。2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O。KClO3+6HCl=KCl+3Cl2+3H2O。
实验室制备氯气的方法
实验室里也可用其他氧化剂来氧化浓盐酸制取氯气。反应原理:最常用MnO2 + 4HCl(浓) ==加热== MnCl2+ 2H2O + Cl2 ↑,常用的氧化剂还有有KMnOKClOCa(ClO)2等。
实验室制备氯气的方法和装置因不同的实验条件而有所不同。以下是几种常见的方法:固相法:在高温下,将含氯元素的无机盐(如氯化钠、氯化钙等)与固体催化剂(如氧化铝、五氧化二钒等)混合研磨,即可得到氯气。
KClO3+6HCl===KCl+3Cl2↑+3H2OCa(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O总之,实验室制氯气的办法都围绕着一个核心:氯离子+氧化剂+酸性环境,氧化剂的氧化性不强的话还需不同程度加热。
实验室制备Cl2一般有3种方法:MnO2+4HCl==△==MnCl2+Cl2↑+2H2O;2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O;KClO3+6HCl=KCl+3Cl2+3H2O。
实验室制法 反应原理:在酸性条件下,用氧化剂氧化-1价的氯的化合物制得。实验室中可以用 浓盐酸 和 二氧化锰 共热来制取,也可以用浓盐酸和 高锰酸钾 反应来制取。反应方程式:MnO?+4HCl=MnCl?+Cl?+2H?O。
氯气的实验室制法方程式
1、氯气的实验室制法:MnO2+4HCl(浓)═△═MnCl2+Cl2↑+2H2O 氯气,化学式为Cl。
2、实验室制氯气方程式为:MnO2 + 4HCl(浓)=(加热) MnCl2+ 2H2O + Cl2 ↑(此为最常用的方法)实验室制取氯气的方法。
3、氯气的实验室制法方程式是MnO2+4HCl==△==MnCl2+Cl2↑+2H2O。氯气(chlorine)是氯元素形成的一种单质,化学式Cl2。常温常压下为黄绿色,有强烈刺激性气味的剧毒气体,具有窒息性,密度比空气大。
氯气的实验室制法有几种?
实验室里也可用其他氧化剂来氧化浓盐酸制取氯气。反应原理:最常用MnO2 + 4HCl(浓) ==加热== MnCl2+ 2H2O + Cl2 ↑ 常用的氧化剂还有有KMnOKClOCa(ClO)2等。
实验室制备Cl2一般有3种方法:MnO2+4HCl==△==MnCl2+Cl2↑+2H2O;2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O;KClO3+6HCl=KCl+3Cl2+3H2O。
除了MnO2外,实验室里也可用其他氧化剂来氧化浓盐酸制取氯气。常用的氧化剂有KMnO4,KClO3,Ca(ClO)2等。(1)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 由于KMnO4的氧化性比MnO2强,所以用KMnO4制Cl2,通常不需加热。
实验室制备氯气的方法和装置因不同的实验条件而有所不同。以下是几种常见的方法:固相法:在高温下,将含氯元素的无机盐(如氯化钠、氯化钙等)与固体催化剂(如氧化铝、五氧化二钒等)混合研磨,即可得到氯气。
氯气的实验室制法如下:二氧化锰(MnO2)和浓盐酸(HCl)混合共热制取氯气,化学方程式 :MnO2+4HCl==MnCl2+Cl2↑+2H2O,反应条件是加热。