铜锌原电池(铜锌原电池现象及结论)
铜锌原电池中的电子流向?
1、电子只能通过导线流动,不能通过溶液。因此是从负极通过导线留到正极。
2、锌和铜形成的原电池中,锌是负极,失去电子;铜是正极,得到电子。所以电子的流向是从锌到铜。而溶液中的反应是:Cu2+ + 2e- == Cu 所以Cu2+是从铜片表面得到电子,所以锌置换出的铜是在铜上。
3、总方程式:2Cu+2HO=2Cu+O+4H铜锌原电池又称丹聂尔电池,其正极是铜极,浸中硫酸铜溶液中;负极是锌板,浸在硫酸锌溶液中。
铜锌原电池是如何表示的?
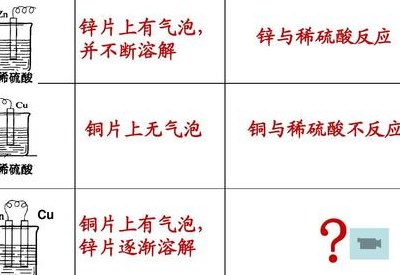
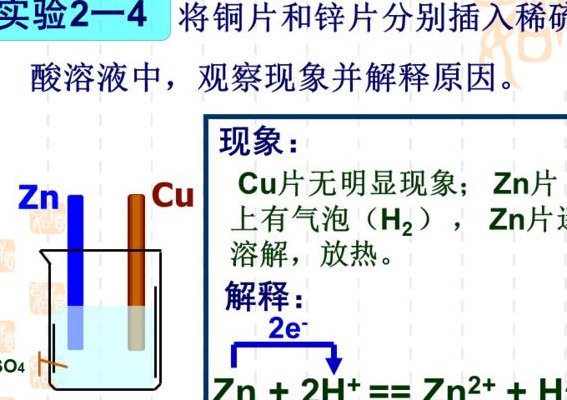
锌和铜在原电池中的反应如下:铜、锌两电极,一同浸入稀硫酸时,由于锌比铜活泼,容易失去电子,锌被氧化成二价锌进入溶液,电子由锌片通过导线流向铜片,溶液中的氢离子从铜片获得电子,被还原成氢原子。
锌棒是负极,铜棒是正极。将正极与负极用导线连接后,电池开始 工作(电子从锌棒经过导线流向铜棒)。
电极反应式是指在电化学装置中表示原子或离子在电极上得失电子发生氧化或还原反应的式子。以铜锌原电池(稀硫酸为电解质溶液)为例,电极反应式。正极2H+ +2e-=H2↑。负极Zn-2e-=Zn2+。
这里首先要有一个自发的氧化还原反应:Zn + 2H+ = Zn2+ + H2 在锌上发生的是:Zn - 2e- = Zn2+ 在铜上发生的是:2H+ + 2e- = H2 失电子,发生氧化反应的一极是负极,得电子,发生还原反应的一极是正极。
智能家居和抽水马达等领域。它也广泛应用于通信系统,汽车电子设备,太阳能发电系统,安全设备等。在航空航天领域,它被用于飞机发动机,火箭发动机,以及耐热设备中。
铜锌原电池反应方程式?
1、电极反应式是指在电化学装置中表示原子或离子在电极上得失电子发生氧化或还原反应的式子。
2、电极反应式是指在电化学装置中表示原子或离子在电极上得失电子发生氧化或还原反应的式子。以铜锌原电池(稀硫酸为电解质溶液)为例,电极反应式。正极2H+ +2e-=H2↑。负极Zn-2e-=Zn2+。
3、可以。烧杯中盛放CuSO4溶液,用导线把Cu板Zn板连起来,再同时浸入到烧杯中的CuSO4溶液中(溶液内Cu板Zn板不要接触),就构成了原电池组。
4、反应方程式为:Zn+Cu2+===Cu+Zn2+ 写出其能斯特方程式:E=E(标准态)+0.0592/2*ln{[Cu2+]/[Zn2+]} 则,Cu2+(铜离子)浓度下降,电压E下降,Zn2+浓度下降,电压上升。
5、这与总反应方程式有关,如果电池总反应为:Zn+Cu2+=Zn2+ +Cu。负极区电解质溶液用可溶性的硫酸锌,氯化锌都可以。
锌铜稀硫酸原电池的电极反应式是什么?
1、被还原成氢原子。氢原子结合成氢分子从铜片上放出。两极发生如下反应:正极:2H+ +2e-=H2↑(稀硫酸溶液为电解质溶液)负极:Zn-2e-=Zn2+ 总反应式:Zn+2H+=Zn2++H2↑ 铜为正极,锌为负极。
2、盐桥起平衡两边电性的作用。锌失电子后硫酸锌溶液正电荷增多,而硫酸铜溶液中铜离子得电子后溶液负电增多,所以盐桥中的k+流向铜极,cl-流向锌极,使两边呈电中性,反应得以继续进行。
3、电极反应式是指在电化学装置中表示原子或离子在电极上得失电子发生氧化或还原反应的式子。以铜锌原电池(稀硫酸为电解质溶液)为例,电极反应式。正极2H+ +2e-=H2↑。负极Zn-2e-=Zn2+。