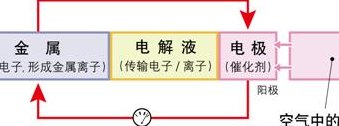
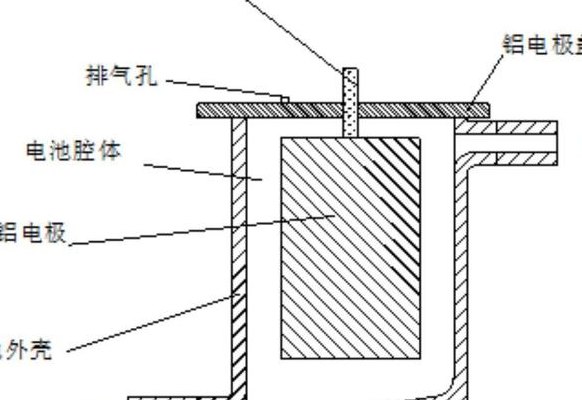
铝空气电池(铝空气电池原理示意图)
不属于金属空气电池的是
1、此外,还有金属-空气电池、燃料电池以及其他能量转换电池如太阳电池、温差电池、核电池等。干电池常用的一种是碳-锌干电池。负极是锌做的圆筒,内有氯化铵作为电解质,少量氯化锌、惰性填料及水调成的糊状电解质,正极是四周裹以掺有二氧化锰的糊状电解质的一根碳棒。
2、它的主要原料是铝,这是一种储量丰富且可回收的金属。在电池放电过程中,产生的副产品主要是氧化铝,这是一种无害的物质,不会对环境造成污染。然而,铝空气电池也存在一些缺点。首先,它的自放电率较高。即使在未使用的情况下,铝空气电池也会逐渐失去电量。
3、金属空气电池为什么不用酸性电解液 锌空气电池(zinc air battery),用活性炭吸附空气中的氧或纯氧作为正极活性物质,以锌为负极,以氯化铵或苛性碱溶液为电解质的一种原电池。又称锌氧电池。分为中性和碱性两个体系的锌空气电池,分别用字母A和P表示,其后再用数字表示电池的型号。
铝空气电池优缺点
然而,铝空气电池也存在一些缺点。首先,它的自放电率较高。即使在未使用的情况下,铝空气电池也会逐渐失去电量。这意味着在长时间储存后,电池的性能可能会显著下降。其次,铝空气电池的充电速度相对较慢。由于铝与氧气的反应速率有限,充电过程需要较长时间才能完成。
其最显著的优势在于质量轻盈。相比于铅酸电池,铝空气电池的总质量仅为45kg,仅为后者的12%,这意味着它能显著降低车辆的整备质量,从而提升装载能力和行驶里程。而且,铝作为原料丰富且可回收,不仅环保,而且生产成本相对较低。安全性和可持续性也是铝空气电池的一大亮点。
虽然铝空气电池含有高的比能量,但比功率较低,充电和放电速度比较缓慢,电压滞后,自放电率较大,需要采用热管理系统来防止铝空气电池工作时的过热。
铝-空气-海水 电池的正极材料是石墨,负极材料是Al(铝)。
首先是铝空气电池的特点是安全性好,因为使用的是水溶液作为电解质,不存在锂离子电池常见的燃烧甚至爆 炸的问题,这一点对车用电池至关重要!锂离子电池之所以会燃烧,就是因为其实用的电解质是有机物,遇到 氧气、水就会放热,同时产气,然后温度一高就烧了。
铝空气电池反应方程式
1、O2+6H2O+12e-=12OH-,4Al—12e-=4Al3+。海水电池是由铝-空气-海水构成的新型电池,铝空气电池反应方程式3O2+6H2O+12e-=12OH-,4Al—12e-=4Al3+。铝空气电池以高纯度铝Al(含铝999%)为负极、氧为正极。
2、铝-空气-海水 电池的正极材料是石墨,负极材料是Al(铝)。
3、沉淀的情况下,产物中产生了沉淀,出现了沉淀现象,才加沉淀符号。铝是固体,所以就不需要加气体符号了。
4、、CO燃料电池(总反应方程式均为2CO+O2=2CO2)(1)熔融盐(铂为两极、Li2CO3和Na2CO3的熔融盐作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气)正极:O2+4e-+2CO2=2CO32-;负极:2CO+2CO32--4e-=4CO2。
5、http://CO燃料电池(总反应方程式均为2CO+O2=2CO2)(1)熔融盐(铂为两极、Li2CO3和Na2CO3的熔融盐作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气)正极:O2+4e-+2CO2=2CO32-;负极:2CO+2CO32--4e-=4CO2。
6、这是原电池反应。。2Al+6H2O=2Al(OH)3+3H2 铝作为原电池的负极失电子变成铝离子,水中的氢离子得电子生成氢气。这是可以反应的,在海水中的航标的即利用这一原理来提供电力。望采纳,十分愿意帮助你。。
(1)金属铝是一种常见的金属,铝-海水-空气电池在航海中得到广泛的应用...
1、铝空气电池的进展十分迅速,它在EV上的应用已取得良好效果,是一种很有发展前途的空气电池。1991年,我国首创以铝-空气-海水为能源的新型电池,称之为海洋电池。它是一种无污染、长效、稳定可靠的电源。
2、铝-空气-海水 电池的正极材料是石墨,负极材料是Al(铝)。
3、年,我国首创以铝-空气-海水为能源的新型电池,称之为海洋电池。它是一种无污染、长效、稳定可靠的电源。海洋电池彻底改变了以往海上航标灯两种供电方式:一是一次性电池,如锌锰电池、锌银电池、锌空(气)电池等。这些电池体积大,电能低,价格高。
铝空气电池的正负极反映及原理,错的就别拿出来秀逗了
铝空气电池的工作原理 铝空气电池以高纯度铝Al(含铝999%)为负极、氧为正极,以氢氧化钾(KOH)或氢氧化钠(NaOH)水溶液为电解质。铝摄取空气中的氧,在电池放电时产生化学反应,铝和氧作用转化为氧化铝。
铝空气电池以高纯度铝Al为负极、氧为正极,以氢氧化钾或氢氧化钠水溶液为电解质。
阳极电势远大于阴极电势,因此反应在外界不提供电能的情况下能进行。若氯化钠溶液浓度过高(接近饱和),可能会发生副反应(阳极:2Cl--2e===Cl2↑),直到氯离子浓度较低。若氢氧化钠浓度较低,可能会发生副反应(阴极:Al-3e+3OH-===Al(OH)3↓),直到氢氧根离子浓度过高。
电极反应 负极:4Al -12e-=4Al3+ 正极:3O2 + 6H2O +12e- = 12OH-总反应为:4Al +3O2 + 6H2O=4Al(OH)3负极材料为:Al;正极材料为:石墨等能导电的惰性材料或活泼性比铝弱的金属材料。